化学浸蚀又称酸洗,是将金属工件泡进酸、酸性盐或碱液中利用化学反应的作用除去金属表面的锈层、氧化皮或氧化膜,体合零件表面的晶体显露出来,处于活化状态以利于电镀时和镀液接触,生成优质的镀层。因此浸蚀是电镀前准备工作的重要组成分,直接影响镀层的质量及工作效率。浸蚀液的成分及工艺条性取根据镀件的基体材料、表面状态、氧化物的性质及电镀工艺的要求决定。浸蚀必须在表面除油之后进行,否则会影响浸蚀的效果,在表面油污较轻的情况下也可以采用除油除锈二合一的酸洗方法。
(一)化学漫蚀除锈的机理
1.金属表面的锈层
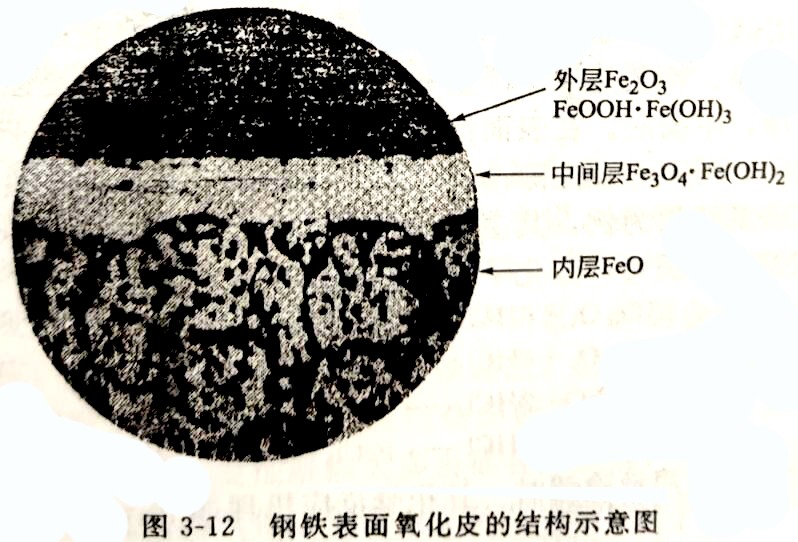
(1)钢和铸铁表面的锈层 钢铁锈蚀的初期表面发暗,轻锈呈暗灰色;中度锈蚀时表面为褐色或红棕色;严重锈蚀时成棕色甚至棕黑色。浅锈的成分一般为三氧化二铁(Fe₂O₃)和少量的氧化亚铁(FeO)。而经高温热处理所形成的氧化皮或长期形成的厚锈,其成分可能由Fe₂O₃、Fe₃O₄和FeO组成。一般来说,外层为Fe₂O₃和Fe₃O₄,内层则为FeO,如图3-12所示。通常采用硫酸、盐酸或硫酸和盐酸组成的混合酸清除这些钢铁的锈层或氧化皮,使氧化皮生成可溶性的铁盐化合物溶于酸液内。
(2)铜和其合金来面的锈层铜及其合金表面的锈层呈绿色,也有的吴棕红色或果色,这主要取决于锈层的氧化物成分。铝育铜表面的锈蚀产物呈白色、暗绿色及黑色。铅青铜的锈层也有呈白色的。一般来说,允许铜及其合金有轻微及均匀的变化。锈蚀的成分及其色泽如下:
CuO·CuO₂(棕红色);CuS(黑色);Cu(OH)₂·CuCO₃(绿色)。
(3)铝合金和镁合金表面的锈层 铝合金和镁合金表面一般都有自然的氧化膜,呈白色或暗灰色且有斑点,严重锈蚀后有白色或灰白色粉末状的锈蚀产物填满蚀坑,这是小孔腐蚀的结果。特别是镁合金表面,其蚀坑深度可达数毫米。铝合金锈蚀产物的成分为Al(OH)3、Al₂O₃、AlCl₃(白色),镁合金锈蚀产物的成分为Mg(OH)₂、MgO、MgCO₃(白色)。
(4)锌、镉、锡金属表面的锈蚀 这些金属的氧化物、氢氧化物和碳酸盐均显灰白色或白色。锈蚀初期呈灰白色斑点,后期变深灰色甚至黑色,并伴有灰白色点蚀坑和白色粉末。
2.化学浸蚀除氧化皮的原理
化学浸蚀去除零件表面锈层及氧化皮主要是利用酸液或碱液和氧化物反应,并生成可溶性的盐类,溶解在化学溶液中,达到清除金属表面氧化皮的目的。除钢铁类的氧化皮以外,一般是采用各种酸溶液如H₂SO₄、HCl、HNO₃及HF等,有色金属如铝合金等则主要采用碱溶液,如NaOH、NazCO₃等。在浸蚀前首先要将表面的油污清除,特别是油污严重的情况下更应先除油再浸蚀,否则除锈不干净,不彻底。在表面油污较少的情况下或对易溶于碱液的金属除锈时,可不必预先除油,可以除油除锈一起通过浸蚀进行。
以钢铁的锈层为例,其主要成分为Fe₂O₃、Fe₃O₄和FeO,当使用盐酸溶液除锈时,其化学反应机理如下:
Fe₂O³+6HCI→2FeCl₃+3H₂O
Fe3O4+8HCl→→2FeCl₃+FeCl₂+4H₂O
FeO+2HCI→FeCl₂+H₂O
Fe+2HCI→→FeCl₂+H₂↑
当使用硫酸溶液除锈时,其化学反应机理如下:
Fe²O³+3H₂SO₄ Fe₂(SO₄)₃+3H₂O
Fe3O₄+4H₂SO₄→Fe(SO₄)₃+FeSO₄+4H₂O
FeO+H₂SO₄→FeSO₄+H₂O
Fe+H₂SO₄→FeSO₄+H₂↑
从上面的反应式中可以看到,在锈层被溶解的同时,伴有铁的溶解并放出氢气。这是因为锈层中可能夹杂有铁原子或当氧化皮有空隙时,酸可以通过疏松的锈层或氧化皮的空洞、裂缝渗透到基材的表面与铁发生反应,使铁溶解。氢气的放出可以强化促进浸蚀过程,因为析出初生态的氢具有很强的还原能力,可以把高价铁还原成低价铁,既有利于氧化物的溶解,又能促进难溶的氧化皮脱落。此外,铁的溶解使锈层与金属基体之间出现孔隙,有利于酸迅速渗透到界面,析出的氢气能对难溶氧化物产生冲击、剥离的作用,提高了浸蚀的效率。不利的是易引起零件基体表面腐蚀过度,变得粗糙不平,并导致零件的几何尺寸改变。析出的氢可能会透入金属的晶格内,造成氢脆或镀层鼓胀等,甚至降低零件的力学性能,对高碳钢、弹簧钢类的零件更为不利,甚至导致零件报废。
通过上述反应机理的分析看到,采用盐酸浸蚀时,由于FeCl₂和FeCl³的溶解度较大,所以盐酸对金属氧化物的溶解能力较强,而对钢铁基体的溶解较慢,析氢作用也较小,不易发生过腐蚀和严重的氢脆。因此可以说盐酸溶液浸蚀的作用主要是靠化学溶解,如果零件表面只有疏松的锈层时,单独采用盐酸浸蚀即可。而采用硫酸浸蚀时,所生成的硫酸盐,特别是Fe₂(SO⁴)³溶解度很小,所以硫酸溶液对金属氧化物的溶解能力相对较弱,但它对铁的作用较强,析氢也相对较多,所以去除氧化皮主要是靠氢气的冲击和剥离作用,化学溶解占据次要的地位。
为了减轻钢铁及其他金属基体在浸蚀过程中的腐蚀和渗氢,防止基体表面出现粗糙不平的现象,一般来说,必须在酸浸蚀液中添加缓蚀剂。缓蚀剂是一种表面活性物质,分子中带有各种极性基团,能吸附在金属表面微阳极区和微阴极区,抑制金属基体表面的电极反应,减少腐蚀电流,降低腐蚀速度,防止基体过腐蚀,而且不会影响酸对氧化层的溶解。缓蚀剂多数为有机物质,主要为硫、氮的化合物。此外,浸蚀溶液大多由混合酸组成,特别是对锈层较厚、成分又较复杂的氧化皮更需由多种化学物质组成,才能取得最佳的浸蚀效果。
(二)常用的浸蚀材料及作用
化学浸蚀又称酸洗或酸洗除锈,因此在化学浸蚀液中主要的成分是各种无机酸,也有的采用有机酸以及一些起辅助作用的添加剂,如缓蚀剂、渗透剂、酸雾抑制剂等。
1.浸蚀常用的酸及其性能
(1)硫酸 硫酸是三氧化硫的水合物,一般的浓硫酸其浓度为98%,价格便宜,对水的稳定性好,在浸蚀除锈中应用广泛。但在室温下对金属氧化物的溶解能力较弱,提高浓度并不能显著增加它的溶解能力,通常以控制在100~250g/L范围内较好。提高温度可增强其浸蚀能力,提高除锈速度和效率,但温度太高会加速钢铁基体的腐蚀和增加析氢,所以一般在50~70℃范围内使用,并适当添加缓蚀剂,以防止过腐蚀和析氢。
(2)盐酸 盐酸是氯化氢气体的水溶液,氯化氢在15℃的水中溶解度最大,可达42%,通常使用的盐酸其质量分数为32%~37%。盐酸对金属氧化物具有很强的浸蚀能力,这主要是浸蚀反应生成的氯化物溶解度大所致。但对铁基体的腐蚀较缓慢,不易造成过腐蚀,析氢也不严重。因此浸蚀后,零件表面附着的残渣较少,容易清洗。盐酸的除锈能力与浓度成正比,但由于盐酸容易挥发,特别是浓度大、温度高的情况下易造成酸雾,所以在实际使用时,并不用浓盐酸,在室温下使用时,不超过360g/L,加热情况下使用的浓度则更低。
(3)硝酸通常使用的是硝酸质量分数为65%的水溶液,硝酸与硫酸、盐酸一起在浸蚀除锈中广泛应用。硝酸是一种强氧化性的酸,浸蚀能力较强。低碳钢在30%的硝酸溶液中浸蚀时表面洁净又光亮。而中、高碳钢和低合金钢浸蚀后,表面附着有残渣,还需要再在碱液中进一步处理。
硝酸和盐酸并添加适量的氢氟酸,可用来浸蚀不锈钢和耐热合金钢零件的表面,并获得光亮的表面。硝酸和硫酸的混合液浸蚀铜、铜合金零件,可获得具有光泽的表面。但在使用硝酸浸蚀的过程中,会放出大量的有毒气体,如NO、NO₂等氮氧化物和大量的热,所以要在通风良好和具有抽风设备的环境中使用,并对废气进行处理。
(4)磷酸 通常使用的磷酸是质量分数为85%的水溶液。磷酸对金属氧化物的溶解能力较弱,一般都要升温操作,质量分数一般控制在20%~45%的范围内使用。磷酸浸蚀的最大优点是残留在工件表面的少量溶液能与工件的基体金属产生反应,生成不溶性的磷酸盐保护膜,适用于焊接件和组合件的前处理。
磷酸与硫酸、硝酸、醋酸或铬酸组成的混合液,常用于钢铁、铜、铝制品的光泽浸蚀。
(5)氢氟酸 氢氟酸属于弱酸,通常使用的质量分数为30%~50%,氢氟酸能溶解含硅的化合物及铝、铬等金属的氧化物。常用于不锈钢及含硅的金属材料表面的浸蚀。质量分数为10%左右的氢氟酸溶液对镁和镁合金腐蚀有缓和作用,适用于镁及其合金的浸蚀。
氢氟酸有毒且挥发性强,使用时应避免与人体接触,以免使人受到伤害,浸蚀设备最好密闭,并有良好的抽风装置,含氟的废气、废水应经处理后才排放。
(6)铬酐 铬酐溶于水后,生成铬酸和重铬酸,具有很强的氧化和钝化能力,但对金属氧化物的溶解能力较弱。常用于浸蚀后的残渣处理或表面钝化处理。
(7)有机酸 有机酸的酸性较弱,单独使用时很难清除金属的氧化皮,在无机酸的浸蚀液中,有机酸常作为添加剂起到加速除锈、除膜及延长溶液使用寿命的作用。例如草酸、柠檬酸和氨基磺酸等常作为添加剂使用。
2.浸蚀溶液常用添加剂
浸蚀液特别是用于除锈层、氧化皮的强浸蚀液一般都使用无机酸或复合酸。为了满足各种需要常在浸蚀液中添加一些添加剂。例如为了防止过腐蚀而添加缓蚀剂,为了改善生产环境,减少污染而添加酸雾抑制剂,为了提高除锈效率而添加渗透剂和络合剂等。
(1)缓蚀剂 为了防止浸蚀过程中基体表面出现过腐蚀以致表面粗糙,零件尺寸减小,以及防止减轻析氢,氢脆现象发生,可以在浸蚀液中添加缓蚀剂。缓蚀剂能选择性地吸附在裸露的基体金属表面而不被金属氧化物吸附。因此,在不影响金属氧化物正常溶解的情况下,可以提高金属表面的析氢超电压而达到减缓对金属的腐蚀和氢脆的目的。对黑色金属,特别是对氢脆较敏感的高强度钢、弹簧钢等,在浸蚀液中,需要加入2%左右的缓蚀剂。常用的有乌洛托品(六亚甲基四胺)、若丁(二邻甲苯硫脲)、尿素、硫脲及其衍生物。另外,丙烯醇、丁烯二醇、丙烯硫醚、硫二乙烯醇等硫氮化合物,若采用硫酸为主的浸蚀液常加入若丁或硫脲,以盐酸为主的浸蚀液则加乌洛托品。缓蚀剂的缓蚀效果随浸蚀液温度的升高而下降。因此,不适宜在加热的情况下使用。
有些缓蚀剂如若丁,能牢固地吸附在金属表面,而且不易清洗干净,从而影响到镀层与基体表面的结合力,因此能不用时尽量不用,或者用其他合适的缓蚀剂代替,非用不可时,要加强浸蚀后的清洗,务必将缓蚀剂清除干净。
(2)渗透剂 渗透剂的作用是加速浸蚀液对氧化层的渗透以便提高除锈除氧化皮的速度。不同的酸浸蚀液用不同的渗透剂。常用渗透剂有无机盐,如氯化钠、氯化镁及亚硫酸钠等,有机渗透剂有T、JFC等。
(3)金属络合物 浸蚀液在除锈的使用过程中,随着溶液中金属离子不断地增多,除锈的速度及效果将逐步下降,若在浸蚀液中增加具有络合作用的物质,就可以消除部分金属离子及杂质离子并使其络合后沉积,延长浸蚀液的使用寿命。常用的络合剂有葡萄糖酸、柠檬酸、羟基乙酸等。同样要注意浸蚀后的清洗工作。
(4)抑雾剂 浸蚀液中使用的无机强酸,特别是盐酸有很强的挥发性。除锈时所挥发出来的气体有很强的腐蚀性,对周围环境有害。因此,必要时可在浸蚀液中加进些非离子型或阴离子型表面活性剂。这些物质具有润湿作用并协助缓蚀剂的有效成分与酸液混合,不至于浮出液面,并在液面形成泡沫以消除酸雾。任何添加物质都会对后续工序造成影响,所以在浸蚀后,同样要加强水洗,把零件表面清洗干净。
(三)常用浸蚀液的配方及工艺条件
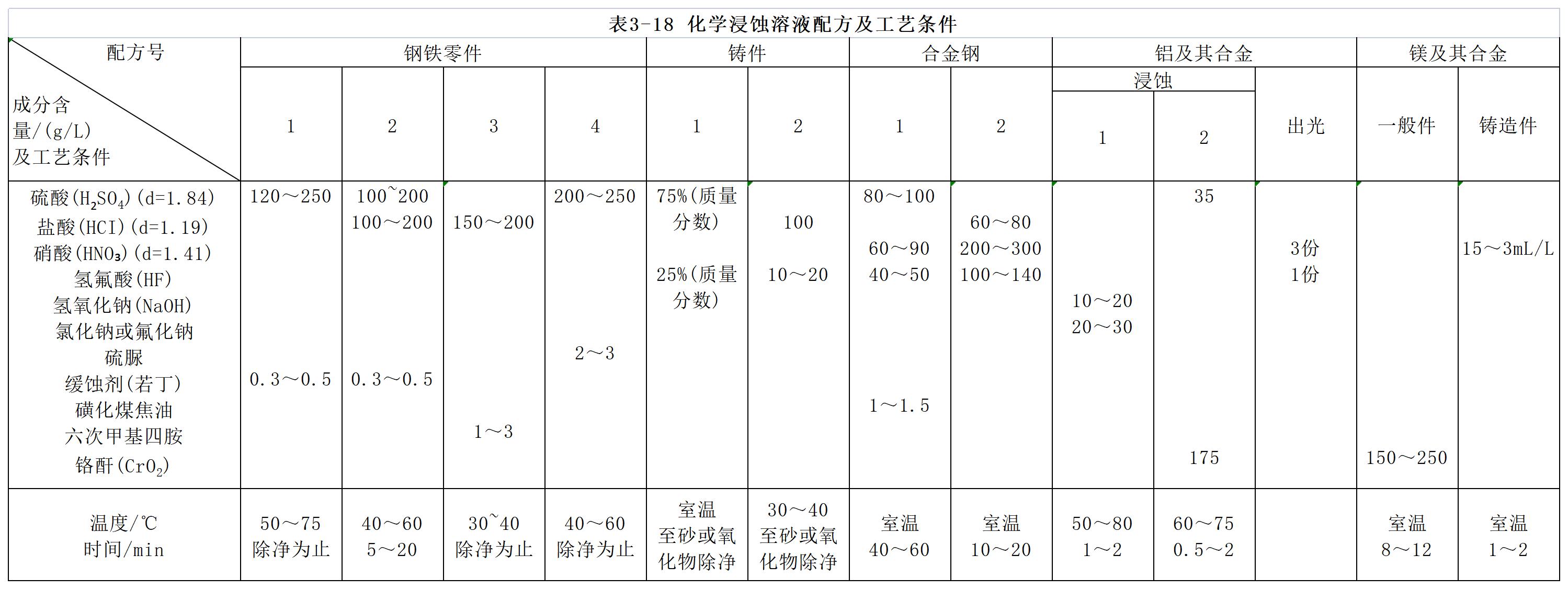
浸蚀溶液的配制及使用,除了上述所提到的各种酸之外,酸的浓度和温度对钢铁工件表面氧化物的清除具有重要的影响。酸的浓度或温度过低,浸蚀速度变慢,过高时使钢铁基体产生过腐蚀。实际上对应于最大的浸蚀速度存在一个最佳的浓度及温度范围。一般来说,硫酸浸蚀液的质量分数应控制在25%以下,温度在30~40℃。强化学浸蚀溶液配方及操作条件见表3-18,仅供参考。
随着浸蚀过程的进行,浸蚀液中的酸含量将逐步减少,影响浸蚀速度,因此,浸蚀液中应不断地补充一些新酸。钢铁零件浸蚀液中,当铁含量达到90g/L时,溶液中酸的质量分数仅有3%~5%,应更换新的浸蚀液,否则影响浸蚀的效果。
(四)弱浸蚀
零件经整平、除油、浸蚀除氧化皮或锈层之后,在运送或存放期间表面会产生一层薄的氧化膜,它将影响镀层与基体金属表面的结合。因此,在进入电镀工序之前还必须进行最后一道工序——弱浸蚀,又称活化。以便除去临时生成的氧化物及其他污染物。金属工件经弱浸蚀后,应马上清洗或中和并进入电镀槽电镀,如果弱浸蚀液对镀液不会造成污染,可以不经清洗,立即进入电镀槽电镀。
弱浸蚀溶液浓度较低,浸蚀能力较弱,不会破坏零件表面的光洁度,一般都在室温下进行,弱浸蚀时间也很短,从数秒到1min。为了提高效率也可以采用电解浸蚀。化学弱浸蚀溶液一般选用质量分数为3%~5%的稀盐酸或硫酸,弱浸蚀液配方及工艺条件见表3-19。弱浸蚀后要立即电镀。若不能立即电镀,应将零件放在稀的Na₂CO₃(3%)溶液中保存,在进行电镀时要洗干净,并重新进行弱浸蚀处理。

本文转载自《电镀前处理与后处理》编著 李异
(想查询更多表面处理文章,您可以扫描下方二维码点击关注公众号:易镀,公众号内有更多详细的表面处理文章,欢迎您的订阅)
易镀,十分专业的表面处理信息平台,金属表面处理/镁合金蚀刻剂/镁合金除油剂/镁合金漂白剂/镁合金转化膜/环保铝除灰剂/铝三价铬钝化剂/低磷化学镍/铝中磷化学镍/高磷化学镍/银光剂/银保护等。
表面处理难题可咨询:13600421922(程生)


Copyright © 2021 深圳市恒享表面处理技术有限公司 All Rights Reserved 备案号:粤ICP备09192382号 技术支持:易百讯 - 深圳网站建设