网站寄语:电镀液是电镀工艺中的关键组成部分,其各部分的成分和比例对镀液及镀层性能有着至关重要的影响。以下是对电镀液各部分成分及其影响的详细分析:
按照金属离子的存在形式,可将电镀液分为简单盐镀液和配合物镀液。这篇文章分别讨论这两类镀液中的主要组分对镀液、镀层性能的影响。
简单盐镀液
常用的简单盐镀液主要包括:硫酸盐镀液、氯化物镀液、硫酸盐-氯化物混合镀液、氟硼酸盐镀液等。在这类镀液中,其主要成分包括主盐、游离酸、导电盐、缓冲剂等。
1.主盐的影响
主盐浓度是电镀工艺中的主要参数之一。简单盐镀液中电镀时,主盐浓度的变化对镀层质量和镀液性能都有一定的影响。实验表明,当温度、电流密度及其他工艺条件不变时,随着主盐浓度的增大,生成晶核的速度降低,晶粒变得粗大。对于那些电镀时不存在显著电化学极化的镀液(如电镀锌、镉、铜、铅等)来说,这种关系比较明显;但对于电镀时发生较大电化学极化的铁族金属来说,则表现并不那么明显。
降低主盐浓度,将使交换电流密度减小,从而在一定程度上增大电化学极化。电化学极化增大,就会使形成晶核的概率增加。除此之外,主盐浓度对晶体结构影响也同晶粒成长过程中的钝化现象有关。当主盐浓度较高时,尽管有可能在电解刚开始的一段时间内形成较多的生长中心,但随着晶体成长表面的增大,真实电流密度随之降低,当降低到某一数值时,部分晶体便开始钝化和停止生长,能够继续生长的只是其中一部分晶体。镀液中的主盐浓度越高,所含钝化剂(杂质)就可能越多,因此晶体数目减少,晶粒变得粗大。但是,不能由此得出镀液的主盐浓度越低就越好的结论。实际上,在镀液所允许稀释的限度下,用降低主盐浓度的方法来改善镀层质量的效果并不明显。采用过稀的镀液,极限电流密度将降低,且易导致形成海绵状沉积层。从加快沉积过程的角度出发,还是应采用主盐浓度较高的镀液。
2.游离酸的影响
在简单盐镀液中,常含有与主盐相对应的游离酸。根据游离酸含量,可将简单盐镀液分为强酸性和弱酸性两类。强酸性镀液中的游离酸不是靠主盐水解而来的,而是在配制镀液时添加进去的。例如,在硫酸盐镀液中电镀铜和电镀锡时常加入过量的硫酸,在氟硼酸盐电镀铅及电镀Pb⁃Sn合金时常加入过量的氟硼酸。加入游离酸的目的:一是为了提高溶液的电导率,以降低槽电压;二是可以提高阴极极化(在一定程度上),以获得结晶细致的镀层;三是为了防止主盐水解。例如,在硫酸盐电镀铜、锡溶液中,可发生如下反应:
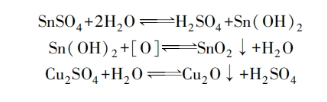
水解反应不但降低了溶液内沉积金属的含量,而且析出的沉淀会使溶液浑浊,以致影响镀层质量。在镀液中加入过量的游离酸,便可防止水解反应的发生。此外,对于这类镀液,大量酸的存在并不至于引起氢的析出,因为铜、锡、铅等都是在较正的电势下沉积的,而且氢在这些金属上析出时具有较高的超电势。但要注意的是,游离酸度提高将会降低主盐的溶解度。
弱酸性简单盐镀液中也含有一定的游离酸,以防止主盐水解。但是,此类镀液不存在过量的游离酸,因为这样会大量析氢而使电流效率下降,所以对于这类镀液必须保持在一定酸度范围内,如电镀锌镀液的pH值为3.5~4.5,电镀镉镀液的pH值为2.0~5.5,电镀锡镀液的pH值为3~4或5.0~5.5。
把镀液的pH值调整到一定范围,并不能保证这个值在电镀过程中维持不变。因为在电镀锌、镉、镍等金属时,阴极上总会有氢气析出,从而使阴极附近镀液中的H+浓度降低,产生所谓的碱化现象。这种现象就导致阴极附近析出氢氧化物(或碱式盐),而使镀层发暗、粗糙,甚至疏松。为了维持镀液pH值在规定范围内,通常需要加入缓冲剂,如在硫酸盐电镀锌液中加入硫酸铝,在硫酸盐电镀镉液中加入硼酸、硫酸铝或醋酸钠,在电镀镍液中加入硼酸。这些缓冲剂的缓冲性质可用下列反应式表示:
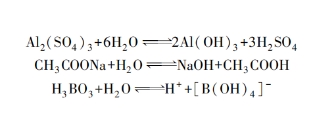
依靠上列可逆反应,酸度可以自动调节。但是,每种缓冲剂只能在一定的pH值范围内起到调节作用,因而对于不同的镀液应选用不同的缓冲剂。在简单盐镀液中,氟硼酸盐镀液具有很好的缓冲性能,即在相当高的电流密度下工作也不会产生碱化现象,所以这种镀液可用于各种金属的高速电镀。
3.导电盐的影响
在简单盐镀液中,常加入一些与主盐阴离子相同的碱金属盐,其目的是增强镀液的导电性,改善镀液的分散能力。常用的盐类为钾盐或钠盐,水化钾离子的半径较小,导电能力较好,但成本相对较高。在含有1%(质量分数)硫酸的0.05mol/LNiCl₂溶液中,当25℃下进行电镀时,曾发现Li⁺、Na⁺、K⁺、NH₄⁺、Ca²⁺、Ba²⁺、Cr³⁺等能使阴极极化有所提高,而Al³⁺及Co²⁺等则降低了阴极极化。外加阳离子对阴极极化的影响在硫酸盐电镀锡时也表现出来,若在SnSO₄镀液中加入碱金属或碱土金属离子,使阴极极化增大的顺序是:Mg²⁺<K⁺<NH₄⁺<Na⁺<Al³⁺。一般来说,外来离子的加入使离子强度增大,致使沉积金属离子的活度降低,从而提高了阴极极化。
4.Cl⁻的影响
在简单盐镀液中,有时含有较大量的Cl⁻离子。镀液中含有的Cl⁻离子,在电镀过程中可以起到活化作用。其作用机理具体表现在:
1)Cl⁻离子与金属离子作用生成易放电的配位离子。
2)Cl⁻离子在电极界面吸附,改变双电层结构及界面状态,使电极的活化能降低,即发生特性吸附。
3)形成“离子桥”,Cl⁻离子外层电子层可变性大,参与组成活化配离子,使Me(H₂O)n脱水及电子转移活化能降低。
根据以上机理,在电镀过程中,Cl⁻离子的具体作用表现在:
1)对阴极过程的活化作用,如硫酸盐电镀铜时,必须加入Cl⁻离子镀层才能全光亮。
2)对阳极过程的活化作用,如用瓦特镀液电镀镍时,若镀液中没有Cl⁻离子,则镍阳极极易发生钝化。
配合物镀液
配合物镀液主要是按配合物的种类进行命名的。常用的电镀配合物包括:氰化物、焦磷酸盐、OH⁻、酒石酸盐、柠檬酸盐等。在这类镀液中,其主要成分包括主盐、配合物及其他成分等。
1.主盐的影响
在配合物镀液中,沉积金属离子通常以配位离子的状态存在。虽然配位离子具有相当高的稳定性,但是总有一部分会电离出来,并建立电离平衡:
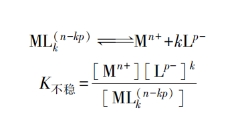
K不稳是配位离子在一定温度下的电离平衡常数,称为不稳定常数,它表达了配合物的稳定性。K不稳越小,配位离子的稳定性就越大。例如,氰化物电镀铜溶液的基本组分为:CuCN35g/L(≈0.4mol/L),NaCN48g/L(≈1.0mol/L)。Cu⁺和CN⁻形成的配位离子可能有[Cu(CN)₂]⁻、[Cu(CN)₃]²⁻、[Cu(CN)4]³⁻等不同形式。根据镀液中CN-与Cu+的比值来看,以[Cu(CN)₃]²⁻形式存在比较合理。在水溶液中[Cu(CN)₃]²⁻的电离平衡为:
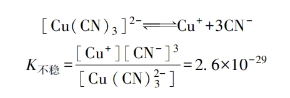
K不稳如此之小,可以认为全部的Cu⁺都配位成[Cu(CN)₃]²⁻,这种配位离子在溶液中的浓度近似地等于0.4mol/L;而游离氰化物(CN⁻)的含量则近似地为1.4mol/L-3×0.4mol/L=0.2mol/L。依据这些近似数值,就可估计出在溶液中游离的Cu⁺的浓度约为:
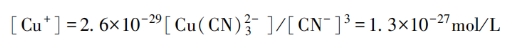
由此可知,氰化物电镀铜溶液的真正组分及其含量为:
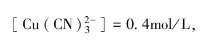
游离[CN⁻]=0.2mol/L。
从这些数据来看,游离Cu+的含量可以忽略不计。如果考虑到1mol铜含有6.023×10²³个离子,那么在10⁴L镀液中才有8个Cu+存在。
以上分析表明,在配合物镀液中,金属离子主要以配位离子的形式存在,几乎没有游离的金属离子。
在配合物镀液中,主盐浓度的变化对阴极极化有较大的影响。例如,在氰化物电镀铜中,随着金属离子浓度的降低,阴极极化增大,同时极化度也较大,这将使镀液的分散能力得到改善。生产上为了获得厚度均匀的镀层,以及使外形复杂的零件能够完全镀上金属,常常采用低浓度的配合物镀液(如氰化物电镀锌)。但是,镀液中金属离子浓度降低,极限电流密度就要下降,析氢也会提前出现,导致阴极电流效率显著下降。因此,为加快电沉积速度,以及为了镀液维护上的便利,往往还是采用金属离子浓度较高的镀液。
2.配合物的影响
(1)配位离子的电化学还原过程 在配合物镀液中,金属离子总是以一定配位数的配位离子形式存在。那么,直接在电极上参与放电的是哪种形式呢?过去曾认为配位离子必须先离解成简单金属离子才能在阴极上放电,阴极极化大的原因是由于配位离子离解成简单金属离子困难而引起的。然而,在配合物镀液中实际上并不存在简单金属离子放电。因此,使阴极极化增大的这种解释是不能成立的。
以氰化物电镀铜为例,在这种镀液中实际上不存在简单金属离子Cu+。假定在1A的电流下向电镀铜槽中通电1s(即通入1C的电量),那么就要有6.023×10²³/96500≈6.2×10¹⁸个离子在电极上放电。如果认为通过配位离子电离能够提供这个数目的简单金属离子,那么把金属离子脱开配位体一个离子半径(约为10⁻⁸cm)的距离算它成为简单金属离子,则6.2×10¹⁸个金属离子就必须在1s内总共走完6.2×10¹⁸×10⁻⁸cm=6.2×10¹⁰cm的路程。这个速度比光速还要大,所以显然是不可能的。
另一种解释是配位离子可以在电极上直接放电,这里所说的配位离子显然是指浓度最大的配位离子品种,即所谓的“主要存在形式”的配位离子。然而,主要存在形式的配位离子往往具有较高的或最高的配位数,同时也具有较低的能量,与其他配位离子相比,这种离子放电时需要的活化能较高,因此它在电极上直接放电的可能性应该是较小的。
究竟是哪种配位离子在阴极上直接放电呢?
人们利用测定电化学反应级数的方法,可以对这个问题做出客观的回答。从表1中可以看出,在一般情况下,直接在电极上放电的总是配位数较低的配位离子。出现这种情况的可能原因之一是配位数较低的配位离子具有适中的浓度及反应能力,因而反应速度比简单离子和配位数较高的配位离子都要大。另外,大多数这类电极反应是在带负电的电极表面上进行的,而不少配位体都带有负电,因而配位数较高的配位离子应更强烈地受到双电层电荷的排斥,这也会导致配位数较高的配位离子不易在界面上直接放电,而使配位数较低的配位离子成为主要的放电离子。
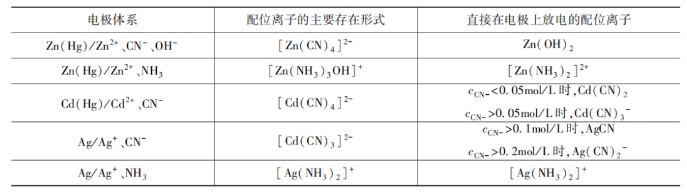
表1 直接在电极上放电的配位离子
必须指出,通过电化学反应级数的测量来确定反应过程的方法还存在一定的局限性,这种方法不能确定参加反应的配位离子是溶液中存在的,还是电极表面存在的。综上所述,配位离子的电化学还原过程大致是:1)镀液中以主要形式存在的配位离子(浓度最大、最稳定的配位离子)在电极表面上转化成能在电极上直接放电的表面配位离子,即化学转化步骤。例如,在碱性氰化物电镀锌(Zn/Zn2+、CN-、OH-)中:
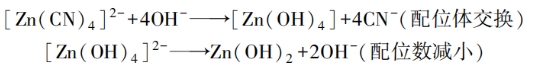
又如,在氰化物电镀镉(Cd/Cd2+,CN-)中:
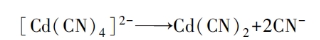
2)表面配位离子直接在电极上放电,如:

又如:
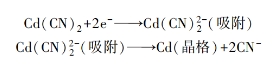
这样,当金属从配合物镀液中沉积时呈现较大的电化学极化,应与中心离子周围配位体转化时的能量变化有关。如果电解中主要存在的配位离子转化为活化配位离子时的能量变化较大,则金属离子还原时所需的活化能就较高,导致电化学极化增大。
(2)配位剂种类的影响 配合物镀液包括焦磷酸盐镀液、酒石酸盐镀液和氰化物镀液等多种。多年来,生产上采用较多的是氰化物镀液。这种镀液虽有剧毒,但可获得良好的镀层。从电极过程来看,金属从氰化物镀液中沉积时往往表现出较大的阴极极化。如上所述,较大的阴极极化是因为氰配位离子转化为能在电极上直接放电的活化配位离子时需要较高的活化能。大多数氰配位离子都具有较小的K不稳值,即比较稳定。配位体转化时的能量变化自然也较大,由此便可以解释为什么氰配位离子还原时往往产生较大的阴极极化。
但是,不能由此得出配位离子的K不稳值越小,其在电极上还原时的阴极极化就越大的结论。K不稳是一个热力学参数,当金属离子形成配位离子时,能量变化(自由能降低)只能影响体系的平衡电势,并不能影响体系的动力学性质,即与金属自阴极上析出的超电势不应该有直接的关系;另一方面,上述配位离子还原的过程会不会出现较大的阴极极化,取决于配位离子转化成活化配位离子时能量的变化,如果溶液中以主要形式存在的配位离子的配位体是活化剂(例如OH-、Cl-等),即使配位离子具有较小的K不稳值,金属析出时仍然不会呈现明显的电化学极化。
综上所述,配位剂种类不同,其对阴极极化、镀液性能、镀层质量的影响是不同的。这种影响取决于配位体的本性(对电极过程是起活化作用还是阻化作用),以及配位离子在转化时的能量变化。配位离子的K不稳值可以影响配位体转化时的能量变化,因而在某些情况下,K不稳值较小的配位离子还原时呈现出较大的阴极极化。但K不稳值与阴极极化并不成反比关系,它只影响体系的平衡电势,而不改变体系的动力学性质,所以K不稳值常常不是阴极极化增大的充分条件,也不可以用K不稳值来预测阴极极化。
(3)游离配位剂浓度的影响 在所有配合物镀液中都必须含有游离的配位剂,配位剂的含量对镀层的质量有很大的影响。游离配位剂的作用如下:
1)使镀液稳定。大多数配合物镀液的配制过程中,总是先生成沉淀,再加入过量的配位剂才能生成可溶性配合物,如:
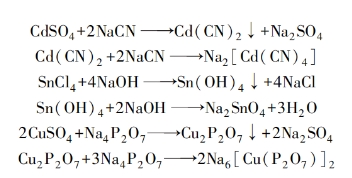
由此可知,如果没有过量的配位剂,配合物是不稳定的。
2)促使阳极正常溶解。在游离配位剂的作用下,阳极表面的金属原子更容易失去电子,从而溶解于镀液中。
3)增大阴极极化。当其他条件不变时,随着游离配位剂含量的提高,阴极极化增大。
因为游离配位剂的含量增加,配位离子更加稳定,使其转化为能在电极上直接放电的配位金属离子就更困难。然而,游离配位剂的含量过高,将使阴极电流效率和允许电流密度的上限下降。因此,对一定的镀液来说,游离配位剂的浓度应控制在一定范围内。
添加剂
添加剂是电镀液中非常重要的组成部分。电镀液中的常用添加剂既包括有机物,也包括无机物,但是有机物应用较多。在有机物添加剂中,又以有机表面活性物质居多。有机表面活性物质的特性吸附对金属电沉积过程动力学有很大影响。例如,在硫酸盐电镀锡液中加入二苯胺等表面活性物质,其对锡电沉积时阴极极化的影响表明,在远小于极限电流密度时,表面活性物质使阴极电势显著降低,当极化增大到一定值时,电流密度急剧上升。此外,两种表面活性物质联合使用,对阴极极化的影响更大。
出现比扩散极限电流小得多而又不随电极电势改变的极限电流,显示了在扩散步骤和电化学步骤以外又出现新的缓慢步骤。对这种现象的解释有两种:一是认为电极表面局部被表面活性物质覆盖,则金属离子在此表面上的放电反应速度相当低,与未覆盖部分的反应速度相比可以忽略不计;二是因添加剂的阻化作用,表现为减少了进行反应的电极表面,即对一部分电极表面起到了封闭作用,所以使阴极极化增加。添加剂没有改变界面反应过程,这种阻化作用称为封闭效应。如果认为电极表面完全被覆盖,金属离子到达电极表面必须穿过这个吸附层,而吸附层的能垒又相当高,致使金属离子越过能垒放电发生更大的困难,此时电极反应速度受吸附层控制,所以出现了数值很小的极限电流。这种吸附层对电极反应的阻化作用称为穿透效应。
在电极表面上,有机表面活性物质的吸附都有一定的电势范围。超过这个范围,表面活性物质就发生脱附。根据实验资料,各类表面活性物质的脱附电势如下:

各种表面活性物质对金属电沉积过程的影响如下:
1)脂肪族烃类(包括醇、醛、酸)对阴极反应有明显的阻化作用,而且可以阻止氢的析出,往往只有当它脱附后才会析出氢气。
2)有机阳离子除了烃基的作用外,还有静电作用,即带正电荷的阳离子对金属离子有排斥作用。一般来说,R越大,R4N吸附电势越低,阴极阻化作用也越明显。
3)芳香烃及其衍生物对金属电沉积有一定的阻化作用,这些物质的吸附有时会使氢气提前析出。
4)烃基短、极性基团大的物质(如乙醇、聚乙二醇等)对电极反应阻化作用不大,只对一些最慢的反应步骤有一些效果。
表面活性物质吸附层对电沉积过程的影响还同电极电势有关。例如,对锌这类析出电势较低且电极表面带负电荷的金属,表面活性物质的用量较小。
在碱性镀液(如碱性电镀锌、电镀锡)中,由于金属的析出电势较低,表面活性物质的作用较小,只有那些烃基不长而极性基团多、介电常数较大的有机化合物(如甘油、乙二醇、非离子型表面活性物质等)有可能在电极上吸附。
采用有机添加剂来改善镀层质量的优点是,只需很小的用量便可收到显著的效果,成本较低。但是,有机添加剂往往会夹杂到镀层中,使镀层脆性增大,并使其他物理化学性质发生改变。
除上述作用外,有机添加剂还具有整平作用、光亮作用及润湿作用等。
PS:综上所述,电镀液中的各部分成分对镀液及镀层性能有着复杂而重要的影响。在实际应用中需要根据具体需求和条件选择合适的成分和比例以获得最佳的电镀效果。


Copyright © 2021 深圳市恒享表面处理技术有限公司 All Rights Reserved 备案号:粤ICP备09192382号 技术支持:易百讯 - 深圳网站建设